Zn + HCl | Cân bằng phương trình Zn + HCl → ZnCl2 + H2

Phản ứng giữa kẽm (Zn) và axit clohidric (HCl) là một quá trình hóa học hấp dẫn trong hóa học cơ bản. Khi Zn + HCl, nó tạo ra phản ứng giải phóng khí hiđro (H₂) và tạo thành muối kẽm clo (ZnCl₂). Đây là một phản ứng oxi-hoá khá phổ biến và cung cấp một ví dụ minh họa cho sự tương tác giữa kim loại và axit. Cùng tìm hiểu chi tiết ngay sau đây.
Lý thuyết về Zn + HCl
Phương trình phản ứng Zn + HCl
Zn + 2HCl → ZnCl2 + H2↑
Đây cũng là một trong các phương trình điều chế khí hiđro phản ứng thế
Điều kiện để phản ứng Zn tác dụng HCl
Nhiệt độ
Điều chế H2 trong phòng thí nghiệm
Trong phòng thí nghiệm để điều chế H2 thường sử dụng axit HCl (hoặc H2SO4 loãng) và kim loại Zn (hoặc Fe, hoặc Al).
Zn + 2HCl → ZnCl2 + H2↑
Khí H2 ít tan trong nước và nhẹ hơn không khí nên ta có thể thu H2 theo 2 cách:
Đẩy nước và đẩy không khí.
Tính chất hóa học của hidro
Hidro tác dụng với oxi
Phương trình hóa học:
2H2 + O2 → 2H2O
Lưu ý rằng khi hỗn hợp khí oxi và khí hidro sẽ gây nổ. Nếu như chúng ta trộn hai khí này theo tỉ lệ 2:1 thể tích Khí hiđro và khí oxi thì hỗn hợp sẽ tạo nổ mạnh nhất.
Nguyên nhân tạo ra hiện tượng này bao nhiêu đó chính là hỗn hợp cháy rất nhanh và tỏa nhiều nhiệt.
Nhiệt này sẽ làm cho thể tích của hơi nước tạo nên sau khi phản ứng tăng cao đột ngột rất nhiều lần. Vì vậy sẽ làm chấn động mạnh đến không khí và gây nổ.
Hidro tác dụng với đồng oxit
Khi cho khí hidro đi qua bột đồng II thì oxit CuO sẽ chuyển thành màu đen.
Khi ống đựng bột CuO được đun nóng ở dưới ngọn lửa của đèn cồn. Sau đó sẽ cho khí H2 đi qua thì ta sẽ nhìn thấy có xuất hiện một chất rắn màu đỏ gạch và sẽ có nước đọng ở trên thành của ống nghiệm.
- Hidro phản ứng với đồng oxit ở nhiệt độ khoảng 400°C
H2 + CuO → Cu+ H2O
Trong phản ứng hóa học trên, hidro đã chiếm chỗ của oxi trong CuO. Ta nói hidro có tính khử.
Nội dung mở rộng của Zn
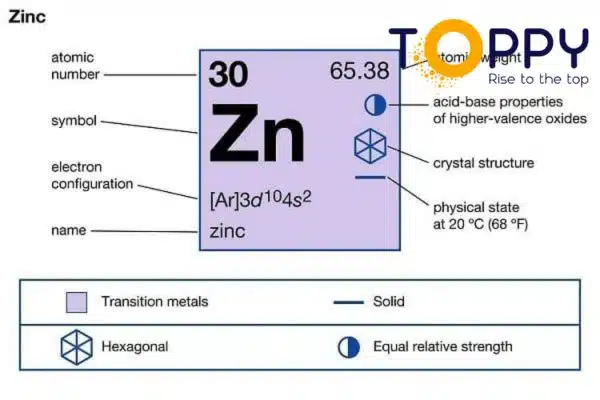
Zn là nguyên tố gì?
Kẽm là một nguyên tố kim loại lưỡng tính thuộc nhóm kim loại chuyển tiếp. Trên bảng tuần hoàn hóa học, Kẽm là nguyên tố nằm ở vị trí thứ 30, trong nhóm 12 (IIB) thì Zn đứng đầu tiên. Kẽm là một nguyên tố phổ biến trên Trái Đất, chiếm vị trí thứ 24 với tỷ lệ 0,0075% (75ppm) trong vỏ Trái Đất. Nồng độ Kẽm trong nước biển là khoảng 30ppb và trong khí quyển là 0,1-4 µg/m3.
Trong tự nhiên, Kẽm thường được tìm thấy kết hợp với các kim loại khác như đồng và chì trong quặng. Kẽm cũng tạo ra quặng Sphalerit khi kết hợp với lưu huỳnh, đó là loại quặng chứa nhiều Kẽm nhất với hàm lượng lên đến 60%. Ngoài ra, Kẽm cũng có mặt trong một số loại quặng khác như smithsonit (Kẽm cacbonat), hemimorphite (Kẽm silicat), wurtzite (loại Kẽm sulfide khác) và hydrozincite (Kẽm cacbonat).
Ngoài ra, Kẽm còn là một nguyên tố quan trọng đối với sự sống, là một chất khoáng cần thiết cho cơ thể. Kẽm đóng vai trò quan trọng trong quá trình tăng trưởng và phân chia tế bào, tham gia vào cấu trúc và duy trì chức năng của nhiều bộ phận trong cơ thể.
Nguồn gốc xuất hiện của Zn (Kẽm)
Vào khoảng năm 1374, Kẽm đã được công nhận là một kim loại và được gọi là “Fasada” trong y học Lexicon của vua Hindu Madanapalle. Lịch sử khám phá và khai thác Kẽm có từ xa xưa. Lần đầu tiên, Kẽm tinh khiết được phát hiện tại Zawar, Rajasthan, khoảng thế kỷ IX. Vào thế kỷ XII, Ấn Độ đã sản xuất Kẽm nguyên chất quy mô lớn.
Đến cuối thế kỷ XVI, Kẽm đã xuất hiện rộng rãi ở Châu Âu. Đến năm 1746, nhà hóa học người Đức, Andreas Sigismund Marggraf, đã được công nhận đã thành công trong việc tách riêng Kẽm kim loại tinh khiết. Tiếp theo, vào năm 1800, Luigi Galvani và Alessandro Volta đã phát hiện ra các đặc tính điện hóa học của Kẽm, mở ra những khám phá quan trọng trong lĩnh vực này.
Zn hóa trị mấy?
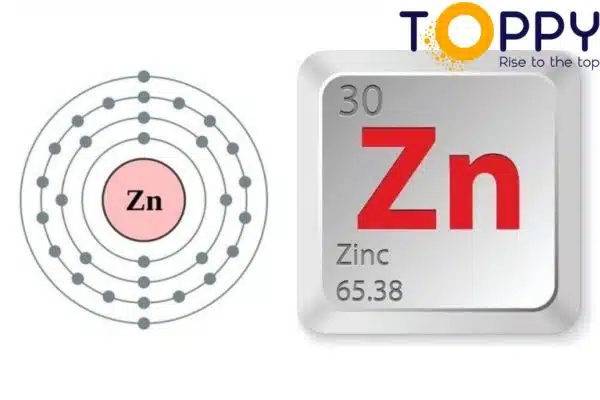
Do số electron ở lớp ngoài cùng của nguyên tố Zn (Kẽm) là 2, vì vậy mà nó có hóa trị là 2. Nó dễ mất 2e hơn nhận thêm 6e, nên phân tử Zn tạo ra icon 2+.
Tính chất vật lý của Kẽm (Zn) là gì?
Kẽm có màu trắng xanh, óng ánh và nghịch từ, tuy nhiên Kẽm phẩm cấp thương mại lại có Kẽm có màu trắng xanh đặc trưng, mang theo một sự ánh kim và nghịch từ. Tuy nhiên, Kẽm sản phẩm thương mại thường có màu xám xỉn.

Kẽm có cấu trúc tinh thể loãng và thuộc loại sáu phương, với một mạng lưới hexagonal không đều. Mỗi nguyên tử Kẽm có sáu nguyên tử gần nhất (cách nhau khoảng 265,9 pm) trong mặt phẳng của chúng, và cũng có sáu nguyên tử khác tại khoảng cách hơn 290,6 pm.
Các thông số vật lý của Kẽm:
- Khối lượng nguyên tử: 65,39mol/l
- Khối lượng riêng: 7,13 g/cm3.
- Điểm nóng chảy: 419,50C (787,10F).
- Điểm sôi: 9070C. Điểm sôi của Kẽm khá thấp, nằm trong số những điểm sôi thấp nhất.
- Độ dẫn điện: 1,6
- Số oxi hóa: 2
- Trạng thái: Rắn
- Cấu hình electron: 1s2 2s2 2p6 3s2 3p6 3d10 4s2
- Nhiệt dung riêng: 0,388JK-1g-1
- Độ cứng theo thang Mohs: 2,5
- Điện trở suất: 0,0596.10-6Ω.m
- Đồng vị bền: 5
- Đồng vị không bền: 10
Các tính chất hóa học của Zn (Kẽm)
Kẽm là một kim loại có mức độ hoạt động hóa học ở mức trung bình. Nó là một chất có tính oxi hóa mạnh. Vì vậy, khi Kẽm cháy trong không khí sẽ tạo ra khối Kẽm oxit mà ngọn lửa có màu xanh lục khá đặc biệt.
2Zn + O2 → 2ZnO
Kẽm cũng là một kim loại có khả năng phản ứng tốt với các axit, kiềm và một số phi kim khác.
- Khi tác dụng với axit:
Zn + H2SO4 → 2H2O + SO2 + ZnSO4
- Khi tác dụng với dung dịch kiềm:
Zn + 2NaOH → Na2ZnO2 + H2
- Khi tác dụng với phi kim:
Zn + Cl2 → ZnCl2
Trạng thái tự nhiên của Kẽm
Kẽm được khai thác nhiều nhất từ quặng Sphalerit, còn được gọi là ZnS (sunfua). Quặng này phân bố rộng rãi ở nhiều quốc gia trên thế giới. Tuy nhiên, các nước chủ yếu tập trung khai thác Kẽm là Úc, Mỹ, Canada, và Iran, đồng thời các quốc gia này cũng có trữ lượng Kẽm lớn nhất.

Kẽm là một kim loại rất quan trọng và được sử dụng rộng rãi. Với sản lượng hàng năm khoảng 13 triệu tấn, Kẽm đứng thứ tư trong danh sách các kim loại được khai thác và sản xuất nhiều nhất trên thế giới. Chỉ sau sắt, nhôm đồng, Kẽm là một trong những kim loại quan trọng nhất trong ngành công nghiệp.
Trên toàn cầu, khoảng 95% lượng Kẽm được khai thác từ quặng Sphalerit (ZnS) sunfua. Thường thì Kẽm trong quặng Sphalerit sẽ kết hợp với các kim loại khác như đồng, chì và sắt sunfua.
Phương pháp sản xuất, điều chế Kẽm (Zn)
Như Admin đã chia sẻ ở trên thì Kẽm là nguyên tố có tính phổ biến và nó đứng thứ 4 thế giới sau: Sắt, đồng, nhôm. Hiện nay, khoảng 70% Kẽm được sử dụng từ hoạt động khai thác quặng Kẽm và 30% còn lại từ hoạt động tái chế. Trong đó 95% Kẽm được khai thác từ quặng Sunfit.
Sau khi quặng Kẽm được khai thác, ngươi ta sẽ tiến hành nghiền nhỏ và đưa vào xử lý qua nhiều công đoạn. Cuối cùng sẽ thu được kim loại Kẽm tinh khiết.
Bắt đầu chuyển Kẽm Sunfit thành Kẽm oxit với sự góp mặt của oxi:
2ZnS + 3O2 → 2ZnO + 2SO2.
Tiếp tục, sẽ tiến hành khử Kẽm oxit bằng Cacbon hoặc CO ở điều kiện nhiệt độ là 9500C. Khi đó kim loại Kẽm được hình thành ở dạng hơi và đem ngưng tụ lại trong bình.
2ZnO + C → 2Zn + CO2
Hoặc 2ZnO + 2CO → 2Zn + 2 CO2
Vai trò của Kẽm với sức khỏe con người
Kẽm là một chất khoáng vi lượng rất quan trọng đối với sinh vật và con người. Nó có vai trò quan trọng trong nhiều khía cạnh sức khỏe:

- Tạo cấu trúc tế bào và hỗ trợ các quá trình enzyme: Kẽm tham gia vào cấu trúc của tế bào và là thành phần cấu tạo của hơn 80 loại enzym khác nhau trong cơ thể.
- Phát triển não bộ: Kẽm cần thiết cho hoạt động của não bộ, đặc biệt là trung tâm bộ nhớ. Ở trẻ nhỏ, việc cung cấp đủ Kẽm giúp não bộ phát triển tốt nhất, tăng cường nhận thức và trí thông minh.
- Tạo hormone và điều hòa glucose: Kẽm tham gia vào việc tạo ra nhiều hormone trong cơ thể, đặc biệt là hormone giới tính. Ngoài ra, Kẽm là thành phần không thể thiếu để sản xuất insulin – hormone giúp điều chỉnh nồng độ glucose trong máu.
- Chuyển hóa chất trong cơ thể: Kẽm tham gia vào quá trình chuyển hóa các nguyên tố vi lượng khác như magie, đồng, nhôm. Đồng thời, nó có tác dụng ức chế độc tính của các kim loại nặng như asen, cadimi.
- Tác động đến sức khỏe da, tóc, móng và hệ miễn dịch: Kẽm là một thành phần cấu tạo da, tóc, móng. Nó cũng kích thích tiêu hóa, tăng cảm giác ngon miệng và tăng cường hệ miễn dịch. Kẽm cũng có vai trò trong việc phòng ngừa thoái hóa giác mạc ở mắt.
Một số nguồn thực phẩm giàu Kẽm
Có nhiều thực phẩm có chứa Kẽm mà chúng ta có thể bổ sung vào chế độ ăn uống hàng ngày. Dưới đây là một số nguồn thực phẩm giàu Kẽm:
- Hạt và hạt chứa Kẽm cao, bao gồm hạt hướng dương, hạt bí, hạt bơ, hạt lanh và hạt mè.
- Thực phẩm họ lúa mì như gạo lứt, lúa mạch, lúa mì, và lúa mì nguyên cám.
- Hải sản và đặc biệt là hàu, tôm, cua, cá hồi và cá ngừ.
- Thịt và gia cầm, bao gồm thịt bò, thịt heo, thịt gia cầm như gà và vịt.
- Sữa và sản phẩm sữa như sữa tươi, sữa chua và phô mai.
- Rau quả, đặc biệt là các loại rau lá xanh như rau cải xoăn, rau bó xôi, măng tây và rau mùi.
- Đậu và sản phẩm từ đậu như đậu nành, đậu đen và lạc.
- Trái cây như chuối, lựu, dứa và táo.

Bài tập vận dụng liên quan Zn + HCl
Câu 1. Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị Hidro khử:
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Câu 2. Sau phản ứng của CuO và H2 thì có hiện tượng gì:
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ
C. Có chất khí bay lên
D. Không có hiện tượng
Câu 3. Điều chế Hidro trong công nghiệp, người ta dùng:
A. Cho Zn + HCl
B. Fe + H2SO4
C. Điện phân nước
D. Khí dầu hỏa
Câu 4. Sau phản ứng Zn và HCl trong phòng thí nghiệm, đưa que đóm đang cháy vào ống dẫn khí, khí thoát ra cháy được trong không khí với ngọn lửa màu gì?
A. Đỏ
B. Xanh nhạt
C. Cam
D. Tím
Câu 5. Cho 6,5g Zn phản ứng với axit clohidric thấy có khí bay lên với thể tích là
A. 22,4 (l)
B. 0,224 (l)
C. 2,24 (l)
D. 4,8 (l)
Câu 6. Các phản ứng cho dưới đây, phản ứng nào là phản ứng oxi hoá- khử?
A. CO2 + NaOH → NaHCO3
B. CO2 + H2O → H2CO3
C. CO2 + 2Mg → 2MgO + C
D. CO2 + Ca(OH)2 → CaCO3 + H2O
Câu 7. Cho các phản ứng sau, phản ứng nào không phải phản ứng thế
A. Fe + 2HCl → FeCl2 + H2
B. Fe + CuSO4 → FeSO4 + Cu
C. H2SO4 + BaCl2 → BaSO4 + HCl
D. Al + CuO → Cu + Al2O3
Câu 8. Dung dịch A chứa 0,4 mol HCl, dung dịch B chứa 0,2 mol KHCO3 và 0,3 mol K2CO3.
Nếu cho từ từ dung dịch A vào dung dịch B thì thoát ra x mol khí . Nếu cho từ từ dung dịch A vào dung dịch B thì thoát ra y mol khí. Giá trị của x và y lần lượt là
A. 0,10 và 0,50
B. 0,30 và 0,20
C. 0,20 và 0,30
D. 0,10 và 0,25
Đáp án D
Nếu cho từ từ HCl (X) vào dung dịch Y, phản ứng 1 và 2 sau đây sẽ xảy ra lần lượt:
HCl + K2CO3 → KHCO3 + KCl (1)
HCl + KHCO3 → KCl + H2O + CO2 (2)
Phản ứng 1: nK2CO3 = nHCl p/u (1) = 0,3 mol
Phản ứng 2: nCO2 = nHCl p/u (2) = 0,4 – 0,3 = 0,1 mol
Nếu cho từ từ Y vào dung dịch HCl (X): phản ứng 3 và 4 sau đây sẽ xảy ra đồng thời:
2HCl + K2CO3 → KCl + H2O + CO2 (3)
HCl + KHCO3 → KCl + H2O + CO2 (4)
Tỉ lệ số mol phản ứng là: nKHCO3 : nK2CO3 = 2 : 3
Đặt số mol KHCO3 phản ứng là x thì số mol K2CO3 phản ứng là 1,5x
Phản ứng 3: nHCl p/u (3) = 2nCO2= 3x
Phản ứng 4: nHCl p/u (4) = nKHCO3 = x
Ta có: nHCl = 4x = 0,4 mol .
Vậy x = 0,1 mol
nCO2 = 1,5x + x. Vậy nCO2 = 0,25 mol
Phản ứng Zn + HCl là một ví dụ minh họa về sự tương tác giữa các chất và sự thay đổi trong cấu trúc hóa học. Nó cung cấp một cái nhìn sâu hơn về tính chất và khả năng của kẽm và axit clohidric khi họ tương tác với nhau.
Xem thêm: