C2H2 ra C2H4 – Cân bằng phương trình C2H2 + H2 → C2H4

C2H2 + H2 → C2H4 là phương trình phản ứng hóa học C2H2 ra C2H4. Hy vọng bài viết sẽ giúp các bạn học sinh làm các dạng bài tập liên quan cũng như dạng bài tập chuỗi phản ứng. Mời các bạn tham khảo nhé.
1. Phương trình C2H2 ra C2H4
Phương trình điều chế C2H2 ra C2H4
C2H2 + H2  C2H4
C2H4
Điều kiện phản ứng xảy ra C2H2 ra C2H4
Nhiệt độ: Nhiệt độ Xúc tác: Palladium (Pd).
2. Nội dung mở rộng C2H2 ra C2H4
Etilen là gì?
Etilen (tên IUPAC là ethene) là một chất khí không màu, không mùi và hơi nhẹ hơn không khí. Đồng thời, nó là một trong các loại hidrocacbon và là một anken (alkene) đơn giản nhất với công thức hóa học là C2H4 hoặc CH2=CH2.
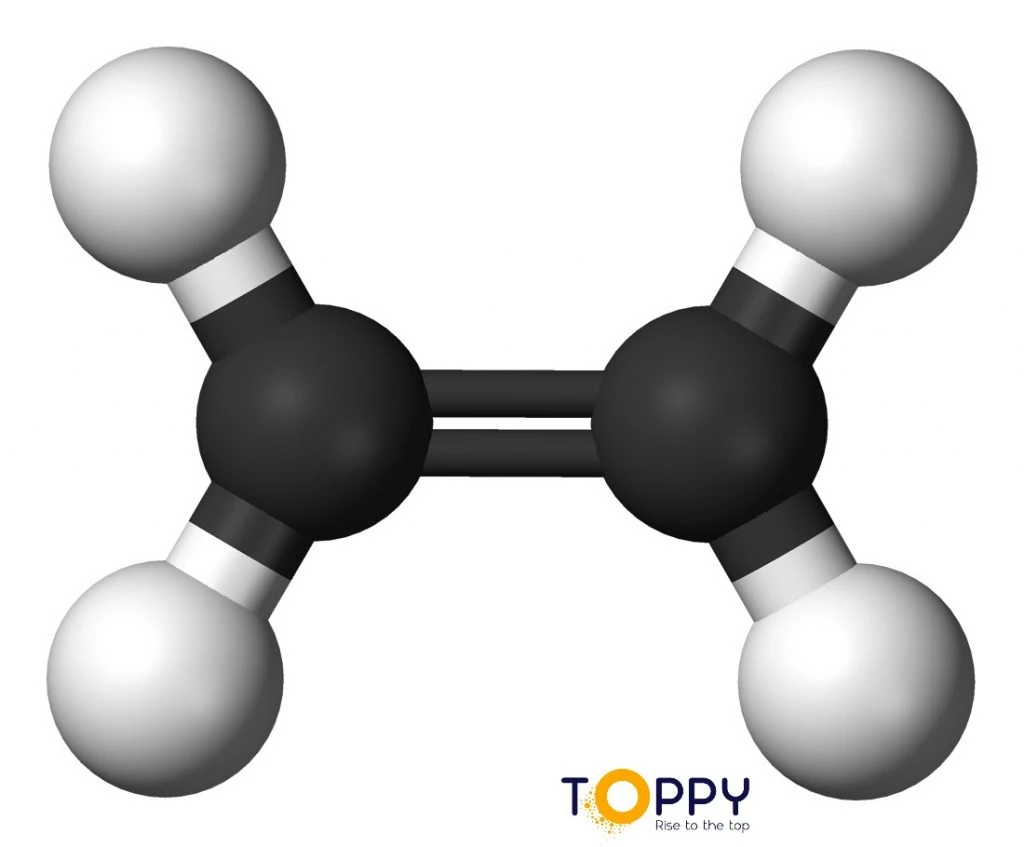
Cấu trúc phân tử của Etilen
Trong phân tử Etilen có một liên kết đôi giữa hai nguyên tử cacbon, bao gồm một liên kết kém bền, dễ dàng đứt gãy khi tiến hành phản ứng hóa học.
Etilen có ở đâu?
Nó được con người phát hiện lần đầu tiên vào năm 1917 và là một trong những chất khí sinh học đầu tiên mà con người biết đến, cũng chính là loại khí Olefin đơn giản nhất.
Bằng cách sử dụng các máy đo cực nhạy và các máy sắc ký khí, người ta đã xác định được rằng, khí Etilen
không chỉ được sinh ra ở trái cây khi chín mà nó còn được sinh ra khi hạt đang nảy mầm, hoa nở hoặc lúc lá già đi… Chính vì vậy mà Etilen rất gần gũi với đời sống của con người.
Tính chất đặc trưng của Etilen
Etilen có những tính chất nào?
1. Tính chất vật lí
– Là chất khí không màu, không mùi, nhẹ hơn không khí.
– Khả năng hòa tan: Ít tan trong nước, 25 ml/100 ml (0 °C) và 12 ml/100 ml (25 °C).
– Nhiệt độ nóng chảy: -169,1 °C
– Nhiệt độ sôi: -103,7 °C
2. Tính chất hóa học
- Tác dụng với oxi:
Đốt cháy trong oxy tạo thành khí CO2 và H2O. Phản ứng tỏa nhiều nhiệt.
C2H4 + 3O2 → 2CO2 + 2H2O + Q
- Tác dụng với thuốc tím
3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2
- Phản ứng với khí clo, brom
Ở nhiệt độ cao, Etilen tham gia phản ứng thế nguyên tử H của liên kết đôi:
CH2=CH2 + Cl2 → CH2=CHCl + HCl
- Tác dụng với dung dịch brom
Làm mất màu dung dịch brom: CH2=CH2 + Br2 → Br – CH2– CH2 – Br
- Tham gia phản ứng cộng
Vì có các chất liên kết đôi nên etilen dễ tham gia phản ứng cộng vơi Halogen, hydro và axit.
C2H4 +Br2 → C2H4Br2
C2H4 +H2 → C2H6
C2H4 + HBr → C2H5Br
- Tham gia phản ứng trùng hợp
Với điều kiện nhiệt độ, phân tử etilen kết hợp với nhau tạo ra chất có phân tử lượng rất lớn gọi là PolyEtiten hay PE. Phương trình phản ứng.
….+ CH2=CH2 + CH2=CH2 +….→ ….- CH2– CH2 – CH2– CH2 -….
Cách điều chế Etilen (C2H2 ra C2H4)
Trong công nghiệp, Etilen được sản xuất bằng bằng phản ứng cracking hoặc tách hydro từ ankan tương ứng.
Trong phòng thí nghiệm, Etilen được điều chế bằng phương pháp đun nóng etanol với axit sulfuric đậm đặc. CH3CH2OH → CH2=CH2 + H2O (H2SO4, to)
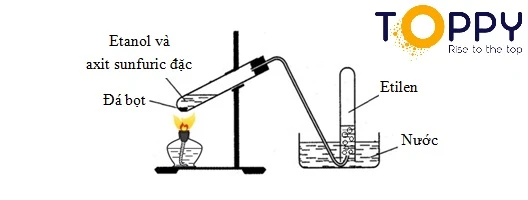
Điều chế Etilen trong phòng thí nghiệm
Các ứng dụng của Etilen
1. Trong nông nghiệp
– Khí Etilen kích thích tăng sinh trưởng của các tế bào thực vật, thúc đẩy quá trình ra hoa, làm chín quả và kích thích sự nảy mầm ở khoai tây, các loại hạt. So với các phương pháp giấm quả khác như sử dụng đất đèn thì Etilen kích thích trái cây nhanh chín hơn, đồng thời, độ chín cũng đều hơn.
Etilen giúp trái cây chín đều màu
– Tăng hiệu quả và chất lượng cho quá trình thu hoạch các loại cây lấy mủ như cao su, thông,…
Tăng hiệu quả quá trình lấy mủ cao su
2. Trong công nghiệp
– Dùng trong sản xuất bao bì, điện tử, dệt may
– Vận chuyển
– Nguyên liệu tạo ra chất phủ, chất kết dính
– Nguyên liệu trong sản xuất vật liệu xây dựng
– Tham gia nhiều phản ứng để sản xuất hóa chất
– Ứng dụng vào ngành hóa dầu, dẫn xuất
Cơ chế tác dụng của Etilen
Cơ chế làm chín trái cây của etilen
Etilen kích thích sự chín của trái cây bằng cách tăng tính thấm của màng trong các tế bào thịt quả, khiến cho các enzym vốn tách rời khỏi cơ chất do màng ngăn cách được giải phóng và có điều kiện tiếp xúc dễ dàng, gây nên những phản ứng có liên quan đến sự chín. Ngoài ra, Etilen cũng ảnh hưởng hoạt hóa lên sự tổng hợp mới các enzym, gây ra những biến đổi trong quá trình chín.
Với trường hợp kích thích sự rụng lá, có thể là do Etilen kích thích sự tổng hợp xenluloza phân hủy tế bào trong các tầng rời.
3. Bài tập vận dụng liên quan C2H2 ra C2H4
Câu 1: Trong phân tử etilen giữa hai nguyên tử cacbon có
A. hai liên kết đôi.
B. một liên kết đôi.
C. một liên kết đơn.
D. một liên kết ba.
Câu 2: Etilen có tính chất vật lý nào sau đây?
A. là chất khí không màu, không mùi, tan nhiều trong nước, nhẹ hơn không khí.
B. là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí màu vàng lục, mùi xốc, ít tan trong nước, nặng hơn không khí.
D. là chất khí không màu, mùi hắc, tan trong nước, nặng hơn không khí.
Câu 3: Khi đốt cháy khí etilen thì số mol CO2 và H2O được tạo thành theo tỉ lệ
A. 2 : 1.
B. 1 : 2.
C. 1 : 3.
D. 1 : 1.
Câu 4: Trong quá trình chín trái cây đã thoát ra một lượng nhỏ khí nào sau đây?
A. metan.
B. etan.
C. etilen.
D. axetilen.
Câu 5: Khí CH4 và C2H4 có tính chất hóa học giống nhau là
A. tham gia phản ứng cộng với dung dịch brom.
B. tham gia phản ứng thế với brom khi chiếu sáng.
C. tham gia phản ứng trùng hợp.
D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước.
Câu 6. Một trong những ứng dụng của axetilen là làm nhiên liệu trong đèn xì để hàn, cắt kim loại. Khi đốt cháy axetilen từ đèn xì (sinh ra nhờ phản ứng của đất đèn với nước) thấy có mùi rất khó chịu. Đó là do
A. Axetilen cháy sinh ra
B. một số tạp chất chứa photpho, lưu huỳnh có trong đất đèn sinh ra.
C. phản ứng của axetilen với kim loại hàn.
D. phản ứng của kim loại được hàn với các thành phần của không khí.
Câu 7. Khi sục dòng khí axetilen vào cốc đựng dung dịch brom thì thấy:
A. Màu của dung dịch nhạt dần, có chất lỏng không màu lắng xuống đáy cốc.
B. Màu của dung dịch nhạt dần, có chất rắn không màu kết tủa
C. màu của dung dịch nhạt dần và có khí hidro bromua bay lên
D. màu của dung dịch đậm dần, có chất lỏng không màu lắng xuống đáy cốc
Câu 8. Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu lần lượt là
A. 20%.
B. 70%.
C. 40%.
D. 60%.
Đáp án Số mol của brom là:
nBr2 =5,6/160 = 0,035 (mol)
Phương trình phản ứng hóa học
C2H2 + 2Br2 → C2H2Br4
Theo PT trên, nC2H2 = 1/2.nBr2 = 0,035/2 = 0,0175 (mol)
⇒ VC2H2 = 0,0175.22,4 = 0,392 (lít)
⇒% VC2H2 = 0,392/0,56.100% = 70%
Câu 9. Cho H2 và 1 anken có thể tích bằng nhau qua Niken nung nóng ta thu được hỗn hợp A . Biết tỉ khối hơi của A với H2 là 23,2. Hiệu suất phản ứng hidro hóa là 75%. Công thức phân tử của aken là
A. C2H4
B. C3H6
C. C4H8
D. C5H10
Đáp án C Công thức tổng quát của anken là CnH2n ta có
Theo giả thiết ta chọn: nH2 = nCnH2n = 1
Phương trình tổng quát
CnH2n + H2 → CnH2n+2
Theo phương trình, số mol khí giảm chính là số mol của H2
H% = 75%
ngiảm = nH2 phản ứng = 1.0,75 = 0,75 mol
nA = nhỗn hợp ban đầu – ngiảm = 2 – 0,75 = 1,25 mol
Áp dụng định luật bảo toàn khối lượng ta có: mH2 + mCnH2n = mA
=> MA = mA: nA => n= 4=> Olefin là C4H8
Câu 10. Để khử hoàn toàn 100 ml dung dịch KMnO4 0,2M tạo thành chất rắn màu nâu đen cần V lít khí C2H4 (ở đktc). Giá trị tối thiểu của V là:
A. 2,240.
B. 2,688.
C. 0,672.
D. 1,344.
Đáp án C Phương trình phản ứng
3CH2=CH2 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2
0,03 ← 0,02
→ VC2H4 = 0,03.22,4 = 0,672 (l)
Trên là các thông tin về phương trình hóa học C2H2 ra C2H4. Để có thể có kết quả cao môn Hóa hãy tham khảo các bài viết của Toppy nhé
Mời các bạn tham khảo thêm một số tài liệu liên quan