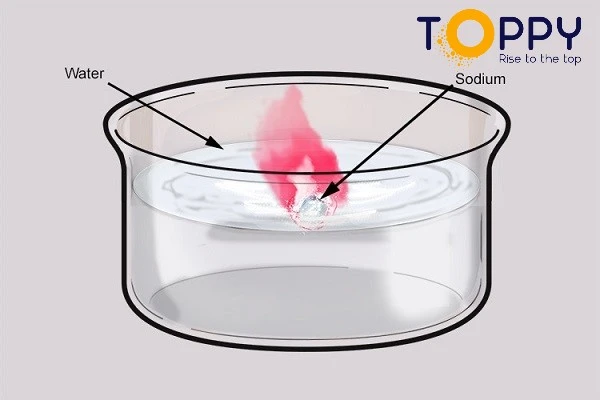
Na + H2o| Phương trình phản ứng hóa học Na + H2O → NaOH + H2

Na + H2O → NaOH + H2 là phương trình phản ứng hóa học giữa kim loại Na + H2o, sau phản ứng có khí thoát ra. Dung dịch sau phản ứng làm quỳ tím hóa xanh. Hy vọng nội dung phương trình phản ứng Na + H2o sẽ giúp bạn đọc học tập cũng như làm bài tập tốt nhất. Mời các bạn tham khảo.
Phương trình Na + H2o
1. Phương trình hóa học Na + H2o
2Na + 2H2O → 2NaOH + H2
2. Điều kiện phản ứng giữa kim loại Na + H2o
Không có
3. Cách thực hiện phản ứng kim loại Na + H2o
Cho mẫu natri vào cốc nước cất
4. Hiện tượng nhận biết phản ứng kim loại Na + H2o
Natri phản ứng với nước, nóng chảy thành giọt tròn có màu trắng chuyển động nhanh trên mặt nước. Mẫu Na tan dần cho đến hết, có khí H2 bay ra, phản ứng toả nhiều nhiệt. Làm bay hơi nước của dung dịch tạo thành, sẽ được một chất rắn trắng, đó là Natri Hidroxit NaOH
5. Tính chất hóa học của kim loại kiềm
Các nguyên tử kim loại kiềm đều có năng lượng ion hóa I1 thấp và thế điện cực chuẩn E0 có giá trị rất âm. Vì vậy kim loại kiềm có tính khử rất mạnh.
Tác dụng với phi kim
Hầu hết các kim loại kiềm có thể khử được các phi kim.
Thí dụ: kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hóa -1:
- Tác dụng với Oxi
Natri cháy trong khí oxi khô tạo ra natri peoxit Na2O2, trong không khí khô ở nhiệt độ thường tạo ra natri oxit Na2O
2Na + O2 → Na2O2
2Na + 1/2O2 → Na2O
b) Tác dụng với Clo
2K + Cl2 → 2KCl
- Với halogen, lưu huỳnh:
Các kim loại kiềm bốc cháy trong khí clo khi có mặt hơi ẩm ở nhiệt độ cao. Với brom lỏng, K, Rb, Cs nổ mạnh, Li và Na chỉ tương tác trên bề mặt. Với iot, các kim loại kiềm chỉ tương tác mạnh khi đun nóng. Khi nghiền kim loại kiềm với bột lưu huỳnh sẽ gây phản ứng nổ.
* Với nitơ, cacbon, silic: Chỉ có Li có thể tương tác trực tiếp tạo Li3N, Li2C2, Li6Si2 khi đun nóng.
Kim loại kiềm tác dụng với axit
Các kim loại kiềm đều có thể khử dễ dàng ion H+ của dung dịch axit (HCl, H2SO4 loãng) thành khí H2 (phản ứng gây nổ nguy hiểm):
2Li + 2HCl → 2LiCl + H2↑
Dạng tổng quát:
2M + 2H+ → 2M+ + H2↑
Kim loại kiềm tác dụng với nước H2O (Na + H2o)
Kim loại kiềm khử được nước dễ dàng, giải phóng khí hiđro:
2Na + 2H2O → 2NaOH (dd) + H2↑
Dạng tổng quát:
2M + 2H2O → 2MOH (dd) + H2↑
Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hỏa.
Nội dung mở rộng Na + H2o
1. Sodium là chất gì?
Sodium là kim loại mềm, màu trắng bạc, là chất có tính khử mạnh
Sodium hay còn gọi là Natri, là tên một nguyên tố hóa học nằm trong nhóm 1 của bảng tuần hoàn. Natri có ký hiệu là Na và số nguyên tử bằng 11, nguyên tử khối natri là bằng 23. Natri nằm trong nhóm kim loại mềm, màu trắng bạc, là chất có tính khử mạnh. Natri có mặt trong nhiều loại khoáng vật như felspat, sodalite và đá muối.
Tùy thuộc vào hàm lượng kim loại và oxit mà Sodium có thể tự cháy trong nước hoặc không. Ở nhiệt độ dưới 115 độ C, kim loại này không cháy trong không khí. Không nên để Sodium tiếp xúc với các chất mà có có phản ứng hóa học.
2. Tính chất hóa học và vật lý của Sodium (Natri)
Cũng giống như các loại nguyên tố hóa học hay những hợp chất khác thì Sodium đều có 2 tính chất đó là vật lý và hóa học.
Tính chất vật lý của Sodium (Natri)
- Sodium là một chất có thể dẫn nhiệt và dẫn điện tốt.
- Sodium sẽ nóng chảy khi được nung nóng với nhiệt độ là 97,83% và sôi ở nhiệt độ 886 độ C.
- Ở những điều kiện ester, Sodium phản ứng tạo nên dung dịch keo màu chàm, tím.
- Sodium có khối lượng riêng là 0,968 g.
Tính chất hóa học của Sodium (Natri)
+ Natri có tính khử rất mạnh: Na → Na+ + 1e
+ Natri tác dụng với phi kim
Khi đốt trong không khí hay trong oxi, natri cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu vàng đặc trưng.
4Na + O2 → 2Na2O
2Na + Cl2 → 2NaCl
+ Natri tác dụng với axit
Natri dễ dàng khử ion H+ trong dung dịch axit loãng (HCl, H2SO4 loãng…) thành hydro tự do.
2Na + 2HCl → 2NaCl + H2.
2Na + H2SO4 → Na2SO4 + H2.
Natri tác dụng với nước
+ Natri tác dụng với nước Na + H2o
Hầu hết Natri đều tác dụng mạnh với nước, tạo thành dung dịch kiềm và giải phóng khí hidro và có thể khiến hydro bị đốt cháy.
2Na + 2H2O → 2NaOH + H2.
+ Natri tác dụng với hidro
Natri tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành natri hiđrua.
2Na (lỏng) + H2 (khí)→ 2NaH (rắn).
3. Ưu và nhược điểm của Sodium
Ưu điểm của Sodium
Sodium là hóa chất được sử dụng rộng rãi trong nhiều ngành sản xuất khác nhau như công nghiệp hóa chất, thủy tinh, luyện kim, sản xuất giấy, dầu mỏ, dệt may, sử dụng trong thực phẩm chế biến…
Sodium giúp tiết kiệm về mặt kinh tế, do chi phí mua và khối lượng nguyên tử thấp.
Nhược điểm của Sodium
Khi cho Sodium tác dụng với nước có thể dẫn đến phát nổ và đây là chất độc có khả năng liên kết và rời liên kết với nhiều nguyên tố khác.
Là sản phẩm khó bảo quản. Sodium chỉ có thể bảo quan trong khí trơ hoặc dầu mỏ.
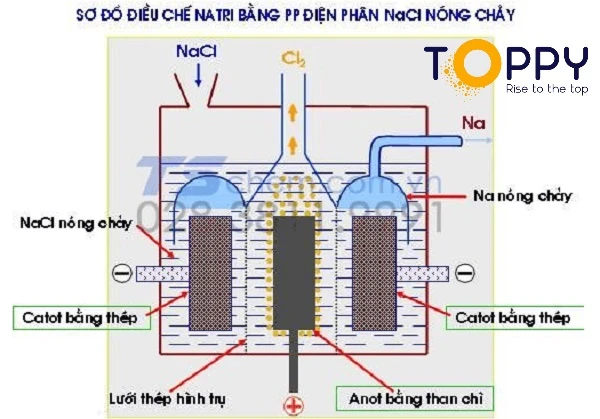
4. Cách điều chế Sodium (Natri)
Điều chế Sodium
Kim loại nguyên chất này không có mặt trong tự nhiên nên Sodium được sản xuất bằng cách điều chế từ các hợp chất của nó. Một số hợp chất quan trọng nhất của Natri là muối (NaCl), bazo như Natri Hydroxit (NaOH – Hóa chất xút vảy), Natri hidrocacbonat (NaHCO3 99% – Bột nở), Natri cacbonat (Hóa chất Na2CO3 99% – Soda).
Do Natri dễ bị oxi hóa nên người ta điều chế bằng cách điện phân muối halogenua hay hiđroxit nóng chảy.
Sau đây là phương trình điện phân
Na+ + e → Na – 2Cl- – 2e → Cl2
2NaCln/c → 2Na + Cl2↑
=> NaCl nóng chảy ở nhiệt độ 800oC nên người ta thêm vào 25% NaF và 12% KCl để hạ nhiệt độ n/c xuống 600oC.
5. Ứng dụng của Sodium trong thực tiễn
Sodium có rất nhiều ứng dụng và dưới đây là một số ứng dụng thực tế của Sodium các bạn tham khảo:
- Cùng với kali, nhiều dược phẩm quan trọng đã cho chất Natri vào để cải thiện ứng dụng sinh học của chúng.
- Sodium chloride được sử dụng rộng rãi để chống đóng băng, khử băng và như một chất bảo quản.
- Chất natri được sử dụng làm kim loại hợp kim, tác nhân chống co giãn và làm chất khử kim loại.
- Một số hóa chất công nghiệp có chứa sodium như muối ăn, bột soda, bột nổi… Những hợp chất này được sử dụng trong sản xuất giấy, thủy tinh, xà phòng, vải dệt, dầu mỏ, hóa chất và kim loại.
- Sodium kết hợp với các hợp chất khác tạo thành sản phẩm sử dụng trong dầu gội đầu, kem đánh răng, nước súc miệng và làm chất tẩy rửa sủi bọt.
- Natri kim loại là thành phần quan trọng trong sản xuất este và các hợp chất hữu cơ.
- Sodium hypochlorite thường được tìm thấy trong các chất tẩy trắng, chất lọc nước và các sản phẩm tẩy rửa.
- Đôi khi chất Sodium còn được sử dụng trong quá trình làm pho mát.
- Sodium lỏng có khả năng truyền nhiệt nên thường được sử dụng như một chất truyền nhiệt trong lò phản ứng hạt nhân.
Sodium giúp bù nước bị mất, duy trì và giữ cho cơ thể phụ nữ mang thai được cân bằng
Bài tập vận dụng liên quan Na + H2o
Câu 1. Khi điều chế Na, người ta điện phân nóng chảy NaCl với anot làm bằng:
A. thép
B. nhôm.
C. than chì.
D. magie.
Cau 2. Cho các phát biểu sau về ứng dụng của kim loại kiềm :
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4
Đáp án C
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
Câu 3. Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75 %.
B. 10,09%.
C. 13,13%.
D. 55,33%.
Đáp án A
Gọi công thức chung của 2 kim loại kiềm là M
Phản ứng xảy ra
M + H2O→ MOH + 1/2H2
nM = 2nH2 = 0,16 mol => M = 3,36/0,16 = 21
=> Li (7)< M = 21 < K (39)
Gọi số mol của K và Li lần lượt là x và y:
Ta có:
% mLi = 0,09.7/3,36 .100% = 18,75%
Câu 4. Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Đáp án A
A sai vì Na2CO3 không bị nhiệt phân
B, C, D đúng
Câu 5. Cho các chất sau : Na, Na2O, NaCl, NaHCO3, Na2CO3. Số chất có thể tạo ra NaOH trực tiếp từ một phản ứng là:
A. 2
B. 3
C. 4.
D. 5.
Đáp án D
Các chất đó là: Na2O; NaCl; Na2CO3, NaHCO3, Na
Na + H2O → NaOH + H2
Na2O + H2O → NaOH
2NaCl + 2H2O 2NaOH + H2 + Cl2
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
NaHCO3 + Ba(OH)2 → BaCO3↓ + NaOH + H2O
=> cả 5 chất đều có thể điều chế trực tiếp ra NaOH bằng một phản ứng.
Câu 6: Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau :
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Câu 7. Trong nhóm kim loại kiềm thổ:
A. Tính khử của kim loại tăng khi bán kính nguyên tử tăng
B. Tính khử của kim loại tăng khi bán kính nguyên tử giảm
C. Tính khử của kim loại giảm khi bán kính nguyên tử tăng
D. Tính khử của kim loại không đổi khi bán kính nguyên tử giảm
Câu 8. Để điều chế kim loại Na, người ta thực hiện phản ứng:
A. Điện phân dung dịch NaOH.
B. Điện phân nóng chảy NaCl hoặc NaOH .
C. Cho dung dịch NaOH tác dụng với dd HCl.
D. Cho dung dịch NaOH tác dụng với H2O.
Câu 9. Có 2 lít dung dịch NaCl 0,5 M. Lượng kim loại và thể tích khí thu được (đktc) từ dung dịch trên là (hiệu suất điều chế bằng 90%)
A. 27,0 gam và 18,00 lít
B. 20,7 gam và 10,08 lít
C. 10,35 gam và 5,04 lít
D. 31,05 gam và 15,12 lít
Đáp án B
nNaCl = 1 (mol)
Phương trình hóa học
2NaCl → 2Na + Cl2
1 1 0.5
mNa= 1x 23 x 90/100 = 20.7 (g)
VCl2 = 0.5 x 22.4 x 90/100 = 10.08 (l)
Câu 10. Cho 1,84 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10% thu được 1,12 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
A. 50,74 gam.
B. 50,84 gam.
C. 47,40 gam.
D. 44,1 gam.
Đáp án A
Ta có
nH2 = 1,12/22,4 = 0,05 mol → nH2SO4 = nH2 = 0,05 mol
Khối lượng H2SO4 là: mH2SO4 = 0,05. 98 = 4,9 gam → mdd H2SO4 = (4,9.100)/10 = 49 gam
Khối lượng dung dịch sau phản ứng là:
mdd sau = mdd bđ + mKL – mH2 = 49 + 1,84 – 0,05.2 = 50,74 gam
Câu 11. Đốt cháy hoàn toàn 6 gam hỗn hợp A gồm Al và Cu cần vừa đủ 2,912 lít hỗn hợp khí gồm O2 và Cl2 thu được 13,28 gam chất rắn. Phần trăm khối lượng của Al trong A là?
A. 36 %
B. 64%
C. 30%
D. 70%
Đáp án A
Áp dụng định luật bảo toàn khối lượng
=> mO2 + mCl2 = mChất rắn – mKL = 13,28 – 6 = 7,28 gam
nO2 + nCl2 = 2,912:22,4 = 0,13 (mol)
Gọi số mol O2, Cl2 lần lượt là x, y
=> Ta có hệ phương trình:
x + y =0,13
32x + 71y = 7,28
=> x = 0,05; y = 0,08
Gọi số mol Al, Cu lần lượt là a, b
Áp dụng định luật bảo toàn electron:
=> Tổng lượng e nhường của kim loại bằng tổng lượng e nhận của phi kim (O2, Cl2)
=> 3a+ 2b = 4. nO2 + 2. nCl2
=> 3a + 2b = 4.0,05 + 2.0,08 = 0,36 (I)
Khối lượng của 2 kim loại bằng 3 gam
=> 27x + 64y = 6 (II)
Từ (I) và (II) => a = 0,08 ; b = 0,06
% Al = (0,08 . 27): 6 . 100% = 36%
Bài viết này đã cung cấp cho bạn các thông tin bài tập liên quan đến phương trình Na + H2o. Nếu có thắc mắc gì hãy bình luận bên dưới để được giải đáp nhé.
………………………….
Ngoài ra các bạn có thể tham khảo thêm một số tài liệu sau: