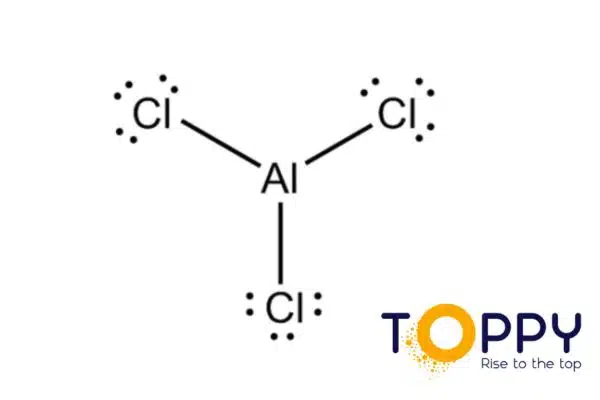
Al + HCl | Trình cân bằng phản ứng hóa học Al + HCl → AlCl3 + H2

Phản ứng giữa nhôm (Al) và axit clohidric (HCl) là một quá trình hóa học đầy thú vị. Khi hai chất này kết hợp, một dòng khí hiđro (H2) được giải phóng, cùng với sự hình thành muối nhôm clohidrat (AlCl3). Đây không chỉ là một phản ứng hóa học phổ biến, mà còn mang trong mình những ứng dụng quan trọng trong công nghiệp và nghiên cứu. Cùng tìm hiểu về phản ứng Al + HCl giúp chúng ta khám phá thêm về tính chất và ứng dụng của hợp chất này trong các lĩnh vực khác nhau.
Lý thuyết về phương trình Al + HCl → AlCl3 + H2
Phương trình phản ứng Al ra AlCl3
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Điều kiện phản ứng xảy ra giữa HCl và Al
Nhiệt độ thường
Al tác dụng HCl có hiện tượng gì?
Al tan dần, có bọt khí không màu xuất hiện
Nội dung mở rộng về AlCl3
Ứng dụng HCl sản xuất AlCl3 công nghiệp
AlCl3 có tính hút ẩm cao và nó có thể phản ứng dữ dội với nước để tạo ra nhiệt và khói. Nó cũng là một axit Lewis mạnh, có nghĩa là nó là chất nhận điện tử và có thể phản ứng với các hợp chất chứa một cặp điện tử đơn độc. Đặc tính này làm cho AlCl3 trở thành thuốc thử hữu ích trong hóa học hữu cơ cho các phản ứng khác nhau như clo hóa, khử nước và phản ứng trùng hợp.
Do tính chất ăn mòn của nó, điều quan trọng là phải thận trọng khi xử lý Nhôm clorua và tuân theo các quy trình an toàn thích hợp khi làm việc với hóa chất này.
- AlCl3 được dùng làm chất xúc tác trong sản xuất cao su tổng hợp và các loại polime khác.
- Nhôm clorua được sử dụng trong sản xuất thuốc nhuộm và bột màu, đặc biệt để tạo màu cho hàng dệt, giấy và sơn.
- AlCl3 được sử dụng làm chất keo tụ trong quy trình xử lý nước để loại bỏ tạp chất và hạt.
- AlCl3 được sử dụng trong sản xuất một số dược phẩm như một chất ổn định hoặc để điều trị chứng tăng tiết mồ hôi (đổ mồ hôi quá nhiều).
- AlCl3 được sử dụng làm thuốc thử trong tổng hợp hữu cơ cho các phản ứng khác nhau như clo hóa, khử nước và tạo vòng.
- AlCl3 được sử dụng trong công nghiệp dầu khí làm chất xúc tác cho quá trình cracking hydrocacbon và sản xuất phụ gia nhiên liệu.
- AlCl3 được dùng làm chất điện phân trong pin và làm chất dẫn điện trong các quá trình điện phân.

Quy trình công nghiệp tạo ra Nhôm clorua (AlCl3)
Nhôm clorua (AlCl3) có thể được sản xuất bằng phản ứng của nhôm (Al) với khí hydro clorua (HCl). Quy trình công nghiệp bao gồm các bước sau:
Chuẩn bị nhôm: Nhôm được sử dụng trong quy trình phải có độ tinh khiết cao và không chứa bất kỳ tạp chất nào có thể ảnh hưởng đến chất lượng của sản phẩm cuối cùng. Nhôm thường được sản xuất theo quy trình Hall-Héroult, bao gồm quá trình điện phân alumin (Al2O3) trong bể cryolite (Na3AlF6) nóng chảy.
Clo hóa nhôm: Nhôm đã chuẩn bị sau đó được đưa vào bình phản ứng, nơi nó được clo hóa bằng khí HCl. Phản ứng diễn ra ở nhiệt độ cao khoảng 350-400°C và thường có mặt chất xúc tác như sắt clorua (FeCl3) hoặc nhôm clorua (AlCl3).
2Al + 6HCl → 2AlCl3 + 3H2
Tinh chế và cô lập AlCl3: AlCl3 được tạo ra trong phản ứng ở dạng hơi, được ngưng tụ để tạo thành chất lỏng. AlCl3 lỏng sau đó được tinh chế bằng cách chưng cất tùy thuộc vào mức độ tinh khiết mong muốn sau đó được đóng gói vào các thùng chứa để vận chuyển và bảo quản.
Điều quan trọng cần lưu ý là quá trình sản xuất công nghiệp AlCl3 bằng khí HCl bao gồm các hóa chất có tính ăn mòn cao và nguy hiểm, đồng thời yêu cầu tuân thủ nghiêm ngặt các quy trình an toàn để tránh bất kỳ tai nạn hoặc thương tích nào. Phải sử dụng hệ thống thông gió thích hợp, quần áo bảo hộ và thiết bị để xử lý hóa chất một cách an toàn.
Bài tập vận dụng liên quan
Câu 1. Cho 1,56 gam hỗn hợp gồm Al và Al2O3 phản ứng hết với dung dịch HCl (dư), thu được V lít khí H2 (đktc) và dung dịch X.
Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch X thu được kết tủa, lọc hết lượng kết tủa, nung đến khối lượng không đổi thu được 2,04 gam chất rắn. Giá trị của V là
- 0,448.
- 0,224.
- 1,344.
- 0,672
Đáp án D
nchất rắn = nAl2O3 = 2,04/102= 0,02 mol => nAl(chất rắn) = 0,02.2 = 0,04mol
Trong hỗn hợp ban đầu có: Al (x mol), Al2O3 (y mol) => mhh = 27x+102y = 1,56 (1)
Bảo toàn nguyên tố Al
nAl(hỗn hợp) = nAl (chất rắn) = x + 2y=0,04 (2)
(1), (2) => x=0,02, y=0,01
2Al + 6HCl → 2AlCl3 + 3H2
0,02 0,03
=> VH2 = 0,03.22,4= 0,672 lít
Câu 2. Cho 2,7 gam Al phản ứng hoàn toàn với dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là
- 4,48.
- 2,24.
- 3,36.
- 6,72.
Đáp án C
Câu 3. Cho sơ đồ phản ứng : Al → X→ Al2O3→ Al
X có thể là
- AlCl3.
- NaAlO2.
- Al(NO3)3.
- Al2(SO4)3.
Đáp án C
Câu 4. Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
- Dung dịch NaOH
- Dung dịch Ba(OH)2
- Dung dịch NH3
- Dung dịch nước vôi trong
Đáp án C
Câu 5. Cho các quặng sau: pirit, thạch cao, mica, apatit, criolit, boxit, dolomit. Số quặng chứa nhôm là:
A.2.
- 3.
C.4.
- 5.
Đáp án B
Phản ứng giữa nhôm (Al) và axit clohidric (HCl) tạo ra một hiện tượng đáng chú ý. Sự tác động của axit lên bề mặt nhôm tạo ra khí hiđro (H2) và muối nhôm clohidrat (AlCl3). Quá trình này không chỉ thú vị từ mặt hóa học mà còn có ứng dụng trong nhiều lĩnh vực như sản xuất công nghiệp và phân tích hóa học. Hiểu rõ về phản ứng Al + HCl sẽ mở ra nhiều cơ hội nghiên cứu, phát triển công nghệ.
Xem thêm: