kclo3 ra o2 | Phương trình phản ứng hóa học KClO3 → KCl + O2

Kclo3 ra o2 được Toppy biên soạn gởi đến các bạn học viết phương trình điều chế oxi từ KClO3. Hy vọng giúp ích cho các bạn học sinh trong quá trình làm bài tập. Mời các bạn tham khảo.
Phương trình Kclo3 ra o2
Phương trình phản ứng hóa học Kclo3 ra o2
2KClO3 2KCl + 3O2
Điều kiện phản ứng Kclo3 ra o2
Nhiệt độ
Ngoài ra các bạn có thể tham khảo thêm phương trình điều chế oxi
KMnO4 → K2MnO4 + MnO2 + O2
Nội dung mở rộng của phương trình phản ứng hóa học Kclo3 ra o2
Kali Clorat là gì?
Kali Clorat là hợp chất hóa học gốc Clorat chứa oxy của clo. Nó là một muối của axit cloric, đồng thời cũng là một chất oxy hóa mạnh, có khả năng tác dụng được với nhiều phi kim và kim loại.
Công thức của Kali Clorat là KClO3.
Một số tên gọi khác: Potassium Chlorate, Potcrate, Chlorate Kali, Natri đại dương, Kali Chlorate, muối Bu,…
Cấu tạo phân tử của KClO3 là gì?
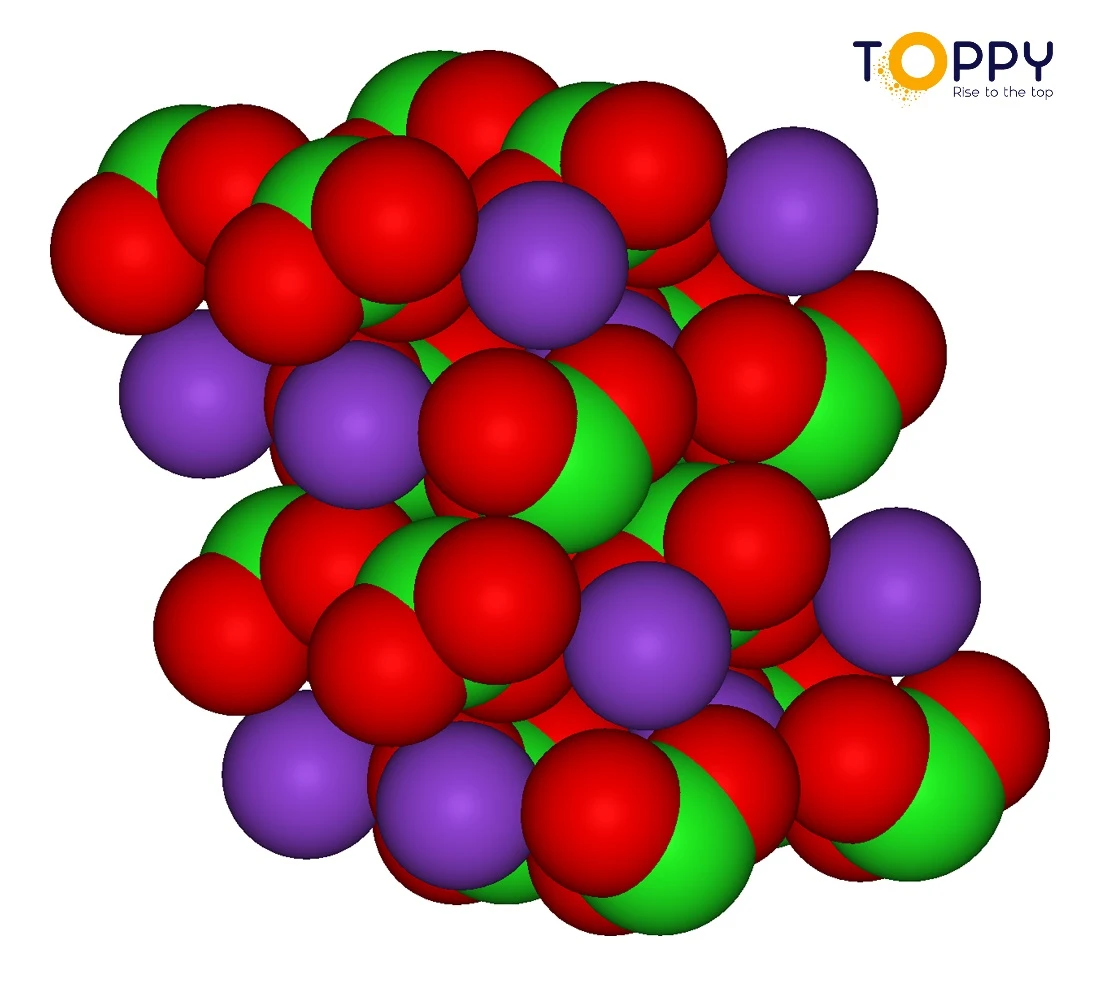
Cấu tạo phân tử KClO3
Tính chất đặc trưng của Kali Clorat KClO3
- Kali Clorat tồn tại ở dạng tinh thể không màu hoặc màu trắng mà không có nước kết tinh, hoặc ở dạng bột màu trắng.
- Nó có vị mặn, lạnh và là một chất độc, có thể gây ngộ độc và tử vong nếu uống vào một lượng từ 2 – 3g.
- Mật độ 2.32g/cm3.
- Điểm nóng chảy 356 ℃.
- Điểm sôi 368 ℃.
- KClO3 tan nhiều trong nước nóng nhưng tan ít trong nước lạnh. Do đó, khi làm lạnh dung dịch bão hòa, chúng ta có thể dễ dàng tách KClO3 ra khỏi dung dịch.
Phương trình phản ứng nhiệt phân muối Kali Clorat KClO3
Trong phòng thí nghiệm, phản ứng nhiệt phân muối được thực hiện dễ dàng theo phương trình hóa học sau:
KClO3 → KCl + O2
Tùy vào lượng nhiệt được cung cấp mà sản phẩm của quá trình nhiệt phân sẽ khác nhau. Cụ thể là nếu nhiệt lượng được cung cấp lên tới 400 ℃, phản ứng sẽ tạo thành 2 muối là Kali perchlorat và Kali Clorua
4KClO3 → 3KClO4 + KCl
Nếu tăng nhiệt độ phản ứng lên 500 ℃ thì sản phẩm sẽ là khí Oxi và muối Kali Clorua.
2KClO3 → 2KCl + 3O2
Tuy nhiên, trong điều kiện phòng thí nghiệm thì khó có thể tạo ra một lượng nhiệt cao đến như vậy. Do đó, để phản ứng nhiệt phân KClO3 tạo ra được oxy dù không cấp đủ lượng nhiệt 500 ℃ thì chúng ta sẽ cần phải thêm chất xúc tác và cụ thể ở đây là Mangan dioxide MnO2.
Ngoài Kali Clorat thì các muối hipoclorit ClO-, muối clorit ClO2- cũng có phương trình nhiệt phân như sau:
2KClO → KClO2 + KCl
3KClO2 → 2KClO3 + KCl
4KClO3 → 3KClO4 + KCl
Sau tất cả các phản ứng thì muối thu được cuối cùng là Kali perchlorat KClO4 và muối này sẽ chỉ bị nhiệt phân ở nhiệt độ ~550 – 620°C để tạo thành muối KCl và O2.
KClO4 → KCl + 2O2

Điều chế Kali Clorat KClO3 bằng cách nào? hãy tìm hiểu phương trình phản ứng hóa học KClO3 → KCl + O2
Có nhiều cách để điều chế Kali Clorat, cụ thể là:
Đun nóng Canxi Clorat với muối Kali Clorua ở nhiệt độ 70 – 75 °C
2KCl + Ca(ClO3)2 ⟶ 2KClO3 + CaCl2
Cho Kali Clorua tác dụng với Natri Clorat ở điều kiện thường
KCl + NaClO3 ⟶ KClO3 + NaCl
Điện phân dung dịch Kali Cloria không vách ngăn trong điều kiện nhiệt độ 70 °C. Phản ứng sẽ làm bọt khí H2 xuất hiện.
H2O + KCl ⟶ H2 + KClO3
Cho Bari Clorat tác dụng với Kali iodat ở điều kiện thường. Phản ứng xảy ra như sau:
Ba(ClO3)2 + 2KIO3 ⟶ 2KClO3 + Ba(IO3)2
Nhiệt phân Kali hypoclorit trong điều kiện nhiệt độ 70 °C. Phản ứng xảy ra như sau:
3KClO ⟶ 3KCl + KClO3
Cho Kali hydroxit KOH tác dụng với khí Clo ở nhiệt độ trên 80 độ C. Phản ứng xảy ra như sau:
3Cl2 + 6KOH ⟶ 3H2O + 5KCl + KClO3
Ứng dụng của Kali clorat – KClO3 và phương trình phản ứng hóa học KClO3 → KCl + O2
– Được trộn lẫn với nhiều loại vật liệu dễ cháy như lưu huỳnh, photpho, bột kim loại,…để chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ..

KClO3 dùng làm pháo hoa
– Dùng để sản xuất diêm: Thuốc ở đầu que diêm thường chứa gần 50% Kali Clrorat.
– Điều chế oxy trong phòng thí nghiệm bằng cách nhiệt phân KClO3 với xúc tác là MnO2.
– Dùng làm chất khử màu trong dệt nhuộm và chất chống oxy hóa.
– Kali Clorat là một chất có tính oxy hóa rất mạnh, khi bị oxy hóa sẽ giải phóng khí oxy nên nó có thể dùng như một chất diệt cỏ.
– Tại Việt Nam, muối Kali Clorat được sử dụng như một chất điều hòa cây trồng trong nông nghiệp.

Muối kali clorat đối với cây trồng
Vai trò của Kali Clorat KClO3 trong việc điều khiển sự ra hoa ở cây nhãn
Khi sử dụng KClO3 ở nồng độ thấp hơn liều lượng để diệt cỏ, chlorate kali sẽ làm lá bị vàng khi phun trực tiếp lên lá và làm rễ, chóp rễ bị phân hủy nếu tưới xuống đất. Hiện nay, việc xử lý cho nhãn ra hoa bằng KClO3 chủ yếu thực hiện bằng cách tưới vào đất để rễ cây nhãn hấp thu và sau đó làm chết rễ.
Đất càng ẩm thì rễ cây nhãn hấp thu hóa chất càng nhanh. Do tác động của chlorate kali mà rễ cây bị chết, đặc biệt là ở các chóp rễ, nơi tổng hợp ra chất điều hòa sinh trưởng chuyển lên thân, lá. Điều này có thể làm cho cây nhãn bị stress và kích thích cây nhãn ra hoa.

Kali Clorat KClO3 – hoa nhãn
Ngoài ra, chúng ta có thể dùng dao cắt khoanh vỏ thân cây nhãn một khoảng rộng chừng 2 – 3mm khi lá ở giai đoạn lá lụa, đồng thời tưới Kali clorat vào gốc cây để tăng tỷ lệ ra hoa trong mùa nghịch…
Bài tập vận dụng liên quan đến phương trình phản ứng hóa học Kclo3 ra o2
Câu 1. Phản ứng tạo O3 từ O2 cần điều kiện :
A. tia lửa điện hoặc tia cực tím
B. Xúc tác Fe
C. Áp suất cao
D. Nhiệt độ cao
Câu 2. Cặp chất nào sau đây không tác dụng được với nhau?
A. Ag và O3
B. CO và O2
C. Mg và O2
D. CO2 và O2
Câu 3. Cho phản ứng hóa học sau:
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
Trong phản ứng trên H2O2 đóng vai trò gì?
A. Chất oxi hóa
B. Chất khử
C. Vừa là chất oxi hóa vừa là chất khử
D. Chất môi trường
Câu 4. Ở nhiệt độ thường
A. O2 không oxi hóa được Ag, O3 oxi hóa được Ag.
B. O2 oxi hóa được Ag, O3 không oxi hóa được Ag.
C. Cả O2 và O3 đều không oxi hóa được Ag.
D. Cả O2 và O3 đều oxi hóa được Ag.
Câu 5. Cho hỗn hợp khí ozon và oxi, sau một thời gian ozon bị phân hủy hết thì thể tích khí tăng lên so với ban đầu là 2 lít. Thể tích oxi và ozon trong hỗn hợp đầu lần lượt là:
A. 2 lít và 5 lít
B. 3 lít và 7 lít
C. 2 lít và 4 lít
D. 4 lít và 6 lít
Ở trên là bài giảng về phương trình phản ứng hóa học Kclo3 ra o2. Đây là một phản ứng hóa học quan trọng nên nếu có gì thắc mắc hãy để lại bình luận bên dưới các bạn nhé. Chúc bạn học thật tốt.
Xem thêm >>>









