so3 ra h2so4 | Cân bằng phản ứng SO3 + H2O → H2SO4

SO3 + H2O → H2SO4 là phương trình phản ứng SO3 ra H2SO4 khi cho SO3 tác dụng với H2O. Đây cũng chính là giai đoạn cuối trong sơ đồ điều chế H2SO4 trong công nghiệp. Hy vọng qua phương trình này bạn đọc sẽ biết cách viết và cân bằng phản ứng. Mời các bạn tham khảo nhé.
Phương trình hóa học SO3 ra H2SO4
1. Phương trình SO3 ra H2SO4
SO3 + H2O → H2SO4
2. Điều kiện phản ứng SO3 ra H2SO4
Nhiệt độ thường
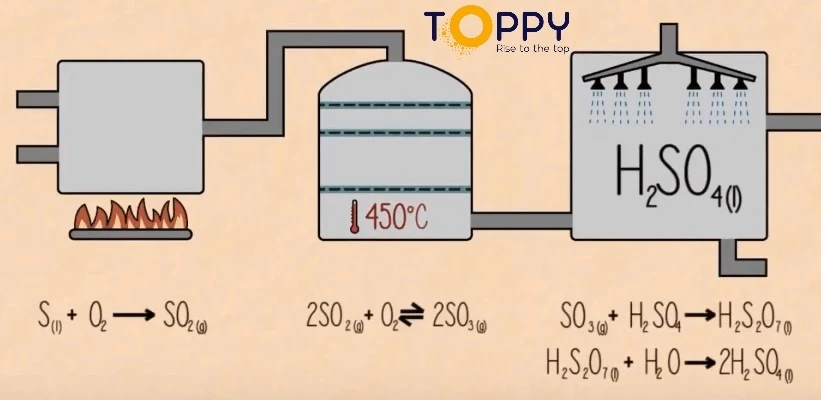
3. Sản xuất H2SO4 trong công nghiệp
FeS2 → SO2 → SO3 → H2SO4
Phương trình hóa học
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2(k) → 2SO3(k)
SO3 + H2O → H2SO4
4. Lưu huỳnh trioxit SO3
a. Tính chất vật lí
Điều kiện thường, SO3 là chất lỏng, không màu.
Nhiệt độ nóng chảy: 17oC; nhiệt độ sôi: 45oC.
Tan vô hạn trong nước và trong axit H2SO4.
b. Tính chất hóa học SO3
Là 1 oxit axit
Tác dụng với nước → dung dịch axit
SO3 + H2O → H2SO4
Chú ý: H2SO4 là 1 axit mạnh và có tính oxi hóa mạnh.
Tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfat và hiđrosunfat)
SO3 + KOH → KHSO4
SO3 + 2KOH → K2SO4 + H2O
SO3 + NaOH → có thể tạo 2 muối: muối axit hiđrosunfat (chứa ion HSO4–); muối trung hòa sunfat (chứa ion SO42-) tùy tỉ lệ.
Tác dụng với oxit bazơ → muối:
SO3 + BaO → BaSO4
c. Ứng dụng
Là sản phẩm trung gian để sản xuất axit H2SO4 có tầm quan trọng bậc nhất trong công nghiệp.
d. Điều chế
Trong công nghiệp:
Phương pháp: oxi hóa SO2 ở nhiệt độ cao.
Phương trình hóa học: 2SO2 + O2 ⇄ 2SO3 (điều kiện: 450 – 500oC; xúc tác: V2O5).
e. Nhận biết
Thuốc thử: dung dịch BaCl2
Hiện tượng: xuất hiện kết tủa.
Phương trình hóa học: SO3 + H2O + BaCl2 → BaSO4↓ + 2HCl
Nội dung mở rộng SO3 ra H2SO4
1. SO3 là gì?
SO3 là một oxit axit của lưu huỳnh được điều chế bằng cách cho lưu huỳnh tác dụng với oxi ở điều kiện thích hợp.
 SO3 ra H2SO4
SO3 ra H2SO4
2. H2SO4 là gì?
H2SO4 là một axit mạnh được điều chế bằng cách cho SO3 tác dụng với nước ở điều kiện bình thường.
Phương trình điều chế H2SO4 từ SO3 được sơ đồ hóa như sau:
SO3 + H2O -> H2SO4
Trong đó:
- SO3 là chất khí.
- H2O là dung dịch.
- H2SO4 là dung dịch mà sau này chúng ta sẽ gặp rất nhiều bài toán nói về nồng độ phần trăm, nồng độ mol của dung dịch axit sunfuric.
Nói một cách khác, lưu huỳnh trong hai hợp chất SO3 và H2SO4 đều có hóa trị là VI.
3. SO3 ra H2SO4 như nào?
Phương trình phản ứng từ SO3 ra H2SO4 như sau:H2O + SO3 ➙ H2SO4
Để điều chế được H2SO4 từ SO3 thì chúng ta dẫn luồng khí SO3 vào dung dịch chứa nước sạch là được. Phản ứng tạo thành H2SO4 không cần điều kiện xúc tác gì cả. Tuy nhiên, để thu được dung dịch H2SO4 có nồng độ đậm đặc thì tỷ lệ SO3 càng cao thì H2SO4 tạo thành càng nhiều nhé các em.
Để điều chế được H2SO4 trong phòng thí nghiệm chúng ta sẽ dẫn luồng khí SO3 thu được vào dung dịch nước tinh khiết cong trong công nghiệp thì sẽ có dàn phun nước xuống một buồng chứa toàn SO3 vừa mới tạo thành. Sơ đồ điều chế H2SO4 các em tham khảo hình ảnh bên dưới này nhé
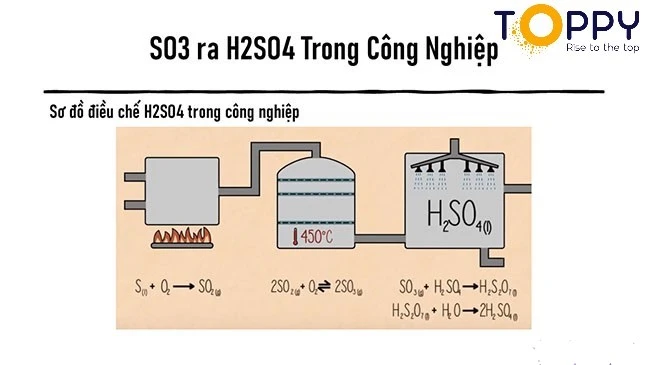
4. Ứng dụng của H2SO4
H2SO4 – Axit Sunfuric là một trong những hóa chất cực kỳ quan trọng trong công nghiệp sản xuất với vai trò là nguyên liệu chính hoặc chất xúc tác nên mỗi năm trên thế giới có khoảng 160 triệu tấn axit sunfuric được ra đời.

Bài tập vận dụng liên quan SO3 ra H2SO4
Câu 1. Sơ đồ điều chế H2SO4 trong công nghiệp là:
A. FeS2 → SO2 → SO3 → H2SO4
B. S → SO2 → SO3 → H2SO4
C. FeS2→ S → SO2 → SO3 → H2SO4
D. S → H2S →SO2 → SO3 → H2SO4
Đáp án A Phương trình hóa học
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 (k) → 2SO3 (k)
SO3 + H2O → H2SO4
Câu 2. Hòa tan hết m gam SO3 vào nước thu được 196 gam dung dịch axit sunfuric có nồng độ 15%. Khối lượng m gam SO3 là
A. 20g
B. 15g
C. 25g
D. 10g
Đáp án AnH2SO4 = mH2SO4/MH2SO4 = (196.12,5/100)/98 = 0,25 (mol)
⇒ nSO3 = nH2SO4 = 0,25 (mol)
⇒ mSO3 = 0,25.80 = 20 g
Câu 3. Khi trộn lẫn dung dịch X chứa 1 mol H2SO4 vào dung dịch Y chứa 1 mol NaOH được dung dịch Z. Dung dịch Z làm quì tím chuyển sang:
A. Màu đỏ
B. Màu xanh
C. Không màu
D. Màu tím
Câu 4. Dãy các chất nào sau đây tan trong nước?
A. Al2O3, CaO, P2O5, CuO, CO2
B. CuO, CaO, P2O5, CO, CO2
C. Na2O, CaO, P2O5, SO3, SO2
D. Fe2O3, BaO, SO2, SO3, SO2
Câu 5. Khí sunfurơ được tạo ra từ cặp chất nào sau đây?
A. Muối natri sunfit và axit cacbonic
B. Muối natri sunfit và dung dịch axit clohiđric
C. Muối natri sunfat và dung dịch axit clohiđric
D. Muối natri sunfat và muối đồng (II) clorua
Câu 6. Dãy oxit tác dụng với dung dịch H2SO4 loãng là:
A. MgO, Fe2O3, SO2, CuO.
B. Fe2O3, MgO, P2O5, K2O .
C. MgO, Fe2O3, CuO, K2O.
D. MgO, Fe2O3, SO2, P2O5.
Câu 7. Dãy các chất tác dụng được với nước tạo ra dung dịch bazơ là:
A. MgO, K2O, CuO, Na2O
B. CaO, Fe2O3, K2O, BaO
C. CaO, K2O, BaO, Na2O
D. Li2O, K2O, CuO, Na2O
————————
SO3 ra H2SO4 là phương trình bạn sẽ bắt gặp rất nhiều trong quá trình học Hóa. Hy vọng bài viết này sẽ giúp bạn hiểu rõ hơn về SO3 ra H2SO4. Nếu có thắc mắc gì hãy mình luận bên dưới nhé.
Xem thêm:


 SO3 ra H2SO4
SO3 ra H2SO4






